الرابطة التساهمية
الرابطة التساهمية : عبارة عن زوج
من الالكترونات يربط بين ذرتين تكون نتيجة مساهمة كلِ من الذرتين بالكترون واحد من
مستوى التكافؤ .
وتتكون الرابطة التساهمية عادةً بين ذرات العناصر اللا فلزية ( متشابهه
أو غير متشابهة ) كما أن العناصر العليا في المجموعة الرابعة ( وأهمها عنصرالكربون
) تميل دائماً إلى تكوين روابط تساهمية ، وقد ترتبط بعض الفلزات ( كالبريليوم )
بروابط تساهمية مع عناصر أخرى .
خواص المركبات التساهمية
في المركبات التساهمية (
بعكس المركبات الأيونية ) يمكن لنا أن نتحدث عن جزيئات مستقلة فالمركبات التساهمية
تتألف من جزيئات مستقلة ترتبط ببعضها بروابط مختلفة ( فان درفال ، هيدروجينية )
متفاوتة في قوتها . لذلك توجد المركبات التساهمية في جميع الحالات الثلاث حسب قوة
هذه الروابط فهناك مركبات تساهمية في حالة غازية ( روابط ضعيفة بين الجزيئات )
ومركبات تساهمية في حالة سائلة وأيضاً يوجد مركبات تساهمية في حالة صلبة ( روابط
قوية بين الجزيئات ) ونفس الشيء بالنسبة لدرجات الانصهار والغليان فالمركبات
التساهمية تتفاوت في درجات غليانها وانصهارها حسب نوعية وقوة الروابط بين الجزيئات
أما بالنسبة للتوصيل
الكهربي ففي الحالة النقية تكون المركبات التساهمية غير موصلة للكهرباء في الغالب
نظراً لكونها غير مشحونة أصلاً أو لكونها متعادلة كهربياً في حالة وجود شحنات ،
ولكن قد يكون للمشحونة منها ما يعرف باسم العزم الكهربي وسيأتي .
وكذلك في مصاهيرها فمصهور المركب التساهمي الصلب (
كمصهور السكر مثلاً ) غير موصل للكهرباء ، أما بالنسبة للمحلول فقد يكون غير موصل
كما في حالة محلول السكر أو يكون موصلاً كما هو الحال في محلول كلوريد الهيدروجين
( حمض الهيدروكلوريك ) ويرجع سبب التوصيل من عدمه في المحلول إلى تأين المركب
التساهمي ( تحوله إلى أيونات منفصلة بفعل المذيب ) أو عدم تأينه
.
فالسكر لا يتأين عند
إذابته في الماء وإنما تنفصل جزيئاته عن بعضها فقط بينما يتأين كلوريد الهيدروجين
إلى أيون الهيدروجين وأيون الكلور .
تراكيب لويس
يمكن تمثيل جزيئات
المركبات التساهمية وتوضيح كيفية تكون الروابط فيها عن طريق ما يعرف باسم تركيب
لويس ، وفيما يلي سنتعرف على تركيب لويس لبعض الذرات وبعض الجزيئات التساهمية :
يلاحظ من خلال هذه
التراكيب أن هناك أزواج الكترونية رابطة ( روابط تساهمية ) وأزواج الكترونية غير
رابطة ( أزواج الكترونية حرة
تطبيق : وضح تركيب لويس لكلٍ من الجزيئات التساهمية
التالية :
جزيء الهيدروجين ، جزيء النيتروجين ، جزيء الماء :
النشادر , الميثان ، فلوريد الهيدروجين ، كلوريد الهيدروجين ، فلوريد البورون ، ،
كلوريد البريليوم ، خامس كلوريد الفسفور .
القاعدة الثمانية
يلاحظ في تراكيب لويس أن
الذرات ( المركزية والطرفية ) في الجزيء التساهمي تحاط بثمانية الكترونات (
بالنسبة للهيدروجين الكترونين ) لتصل بذلك إلى التركيب الالكتروني الثابت والمستقر
لتماثل التركيب الالكتروني لأقرب غاز خامل ، تعرف هذه الظاهرة باسم القاعدة الثمانية
، وبالرغم من أن هذه الظاهرة تنطبق على معظم الجزيئات التساهمية إلا أن هناك
شذوذاً عن هذه القاعدة إما بأكثر من ثمانية الكترونات كما هو الحال في خامس كلوريد
الفسفور ( يوجد عشرة الكترونات حول ذرة الفسفور المركزية ) أو أقل من ثمانية كما
هو الحال في فلوريد البورون ( ستة الكترونات حول ذرة البورون المركزية ) .
جزيء ثالث فلوريد الفسفور يتبع القاعدة الثمانية
جزيء خامس فلوريد الفسفور يشذ عن القاعدة الثمانية
الأشكال
الهندسية للجزيئات التساهمية
كما هو معروف فإن
الجزيئات التساهمية عبارة عن جزيئات مستقلة تتألف من ذرة مركزية وذرة أو أكثر
طرفية ويوجد حول الذرة المركزية عدد من الأزواج الالكترونية الرابطة أو ( الرابطة
وغير الرابطة ) . ونظراً لأن هذه الأزواج الالكترونية تتألف من الكترونات سالبة
متشابهة في الشحنة فالمتوقع أن يكون هناك تنافر بينها ، هذا التنافر بين الأزواج
الالكترونية الموجودة حول الذرة المركزية في الجزيء التساهمي يجبرالجزيء التساهمي
على اتخاذ شكل هندسي في الفراغ يحدده عدد هذه الأزواج الالكترونية . ويتحدد مقدار
الزوايا بين هذه الروابط على نوعية الشكل الهندسي الفراغي الذي يتخذه الجزيء وعلى
عدد الأزواج الالكترونية الحرة الموجودة بالجزيء.
ومن أهم
هذه الأشكال الهندسية للجزيئات التساهمية ما يلي :
* الشكل الخطي
ومثاله كلوريد البريليوم BeCl2
* المثلث
متساوي الأضلاع ومثاله فلوريد البورون BF3
* الهرم
الرباعي السطوح ومثاله مايلي :
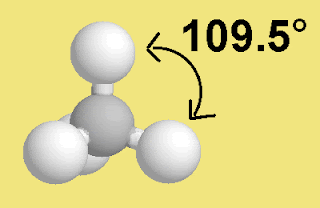
الميثان CH4
ومثله أيون الأمونيوم +NH4
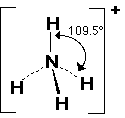
النشادر NH3
ومثله أيون الهيدرونيوم +H3O
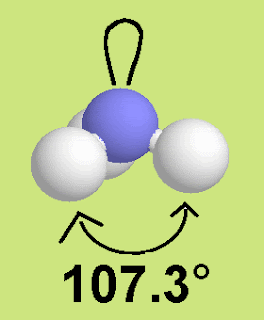
الماء H2O
يلاحظ في شكل الهرم الرباعي السطوح أن وجود أزواج
الكترونية حرة في الجزيء يؤدي إلى صغر الزوايا بين الروابط وذلك لأن التنافر بين
زوج رابط وزوج حر أكبر من التنافر بين زوج رابط وزوج رابط .
فيلاحظ أن الزاوية في النشادر صغرت عن الميثان
وأصبحت تساوي 107 درجة والسبب وجود زوج الكتروني حر على ذرة النيتروجين المركزية .
كما أن وجود زوجين غير رابطين ( حرين ) يؤدي إلى
المزيد من التنافر وصغر الرابطة فالزاوية في الماء 104.5 درجة وهي أصغر من مثيلتها
في كل من الميثان والنشادر والسبب وجود زوجين حرين على ذرة الأكسجين في الماء .
مما سبق يتضح لنا أن الشكل الهندسي للجزيء التساهمي
يعتمد على عدد الأزواج الالكترونية الموجودة حول الذرة المركزية في الجزيء .
فعندما يكون هناك زوجين الكترونين حول الذرة
المركزية فإن الشكل الهندسي للجزيء يكون مستقيماً (
Linear )كما هو الحال في كلوريد البريليوم ( وكذلك في حالة
وجود زوج الكتروني واحد ) .
وثلاثة أزواج الكترونية
------------> مثلث
مسطح (
Trigonal Planar )
أربعة أزواج الكترونية
------------> هرم
رباعي السطوح (
Tetrahedral )
خمسة أزواج الكترونية
------------> مثلث
مزدوج (
Trigonal Bipyramid )
ستة أزواج الكترونية
------------> هرم
ثماني السطوح (
Octahedral )
مثلث مزدوج
هرم ثماني السطوح
وتختلف الزوايا في الشكل
الهندسي الواحد تبعاً لعدد الأزواج الالكترونية الحرة ، فنجد في الميثان مثلاً
الشكل الهندسي عبارة عن هرم رباعي السطوح منتظم والزاوية فيه 109.5 درجة ، بينما
في النشادر يكون هرم رباعي السطوح غير منتظم ومقدار الزاوية 107 درجة وفي الماء
هرم رباعي السطوح غير منتظم والزاوية 104.5 درجة والسبب في ذلك يعود لاحتواء جزيء
النشادر على زوج الكتروني حر وفي الماء زوجين الكترونين حرين وكما ذكرنا في السابق
فإن التنافر بين زوج رابط وزوج حر يكون أكبر من زوج رابط وزوج رابط والتنافر بين
زوج حر وأخر حر أكبر من التنافر بين زوج رابط وزوج حر .
السالبية الكهربية للعناصر :
كما هو معلوم فإن ذرات
العناصر تتفاوت في طاقة تأينها ( مدى فقدانها للالكترونات ) وفي ألفتها
الالكترونية ( قابليتها لاكتساب الالكترونات ) لذا فإننا نتوقع أن الأزواج الالكترونية
الرابطة في الجزيئات التساهمية يمكن أن تكون أقرب إلى إحدى الذرتين المكونتين
للرابطة التساهمية من الأخرى .
وتعرف قابلية ذرة العنصر في الجزيء التساهمي
للاستئثار بالزوج الالكتروني الرابط بالسالبية الكهربية . ومن البديهي القول أنه
كلما أزدادت قابيلة ذرة العنصر للاستئثار بالزوج الالكتروني الرابط ازدادت سالبيته
الكهربية .وعموماً فإنه يمكننا القول بأن ذرات العناصر التي تتمتع بطاقة تأين
مرتفعة وألفة الكترونية مرتفعة يكون لها كهروسالبية ( سالبية كهربية ) عالية .
قطبية الجزيئات التساهمية :
يقصد بالقطبية احتواء
جزيء المركب التساهمي الواحد على شحنتين مختلفتين بحيث يكون هناك طرف موجب ( جزء
تتركز فيه الشحنة الموجبة ) وطرف سالب ( جزء تتركز فيه الشحنة السالبة ) بمعنى أن
يكون في الجزيء قطبين مختلفين في الشحنة .
وفي الحقيقة فإن قطبية الجزيء التساهمي ناتجة من قطبية
الروابط التساهمية المكونة له ، فالمركبات التساهمية المحتوية على روابط قطبية
تكون مركبات قطبية والمركبات التي لا يوجد بها روابط قطبية تكون مركبات غير قطبية
والسؤال الذي يطرح نفسه هنا ،
متى تكون الرابطة التساهمية قطبية ؟ ومتى تكون غير قطبية ؟
والجواب على هذا السؤال
يستلزم العودة إلى مفهوم السالبية الكهربائية فكما ذكرنا سابقاً فإن الكهروسالبية
عبارة عن مدى قابلية ذرة العنصر للاستئثار بالزوج الالكتروني الرابط ، فعندما
تتكون رابطة تساهمية بين ذرتين متساوتين في السالبية الكهربية ( متماثلتين أو غير متماثلتين
) فإن الرابطة تكون غير قطبية ، أما عندما تتكون الرابطة التساهمية بين ذرتين
مختلفتين في السالبية الكهربية فإن الرابطة تكون قطبية والسبب في ذلك أن الذرة ذات
السالبية الكهربية العالية سوف تستأثر بالزوج الالكتروني الرابط ( تجذبه نحوها
بمقدار أكبر ) مما يجعل الشحنة السالبة تتركز عليها جزئياً ( قطب سالب ) وفي
المقابل ستتكون شحنة موجبة جزئية ( قطب موجب ) على الذرة الأقل في السالبية
الكهربية .
ومن المهم الإشارة هنا
إلى أنه لكي تكون الرابطة التساهمية قطبية فإنه يجب أن يكون الفرق في السالبية
الكهربية بين العنصرين كبيراً نوعاً ما ( أكثر من 0.5 ) وكلما زاد هذا الفرق زادت
قطبية الرابطة وزادت قطبية المركب .
ويمكن التعرف على مدى
قطبية مركب ما عملياً عن طريق قياس ما يعرف باسم ( العزم الكهربائي ) Electric Dipole
moment ويعرف العزم القطبي بقابلية جزيئات المادة
للانتظام في مجال كهربي ، فالقيم الكبيرة للعزوم القطبية تشير إلى مواد ذات قطبية
عالية .
وثمة عامل أخر مؤثر في
قطبية الجزيئات وهو الشكل الهندسي الفراغي فالمركبات التي تتخذ جزيئاتها أشكالاً
هندسية متماثلة (
Symmetric) تكون غير قطبية حتى ولو كان الفرق في
السالبية الكهربية للعناصر المكونة لها كبيراً ، وذلك لأن محصلة العزوم الكهربية
في الجزيء المتماثل تساوي صفراً .
جزيء رابع كلوريد الكربون
بالرغم من أنه يحوي روابط قطبية إلا أنه جزيء غير قطبي .






















This comment has been removed by a blog administrator.
ReplyDelete